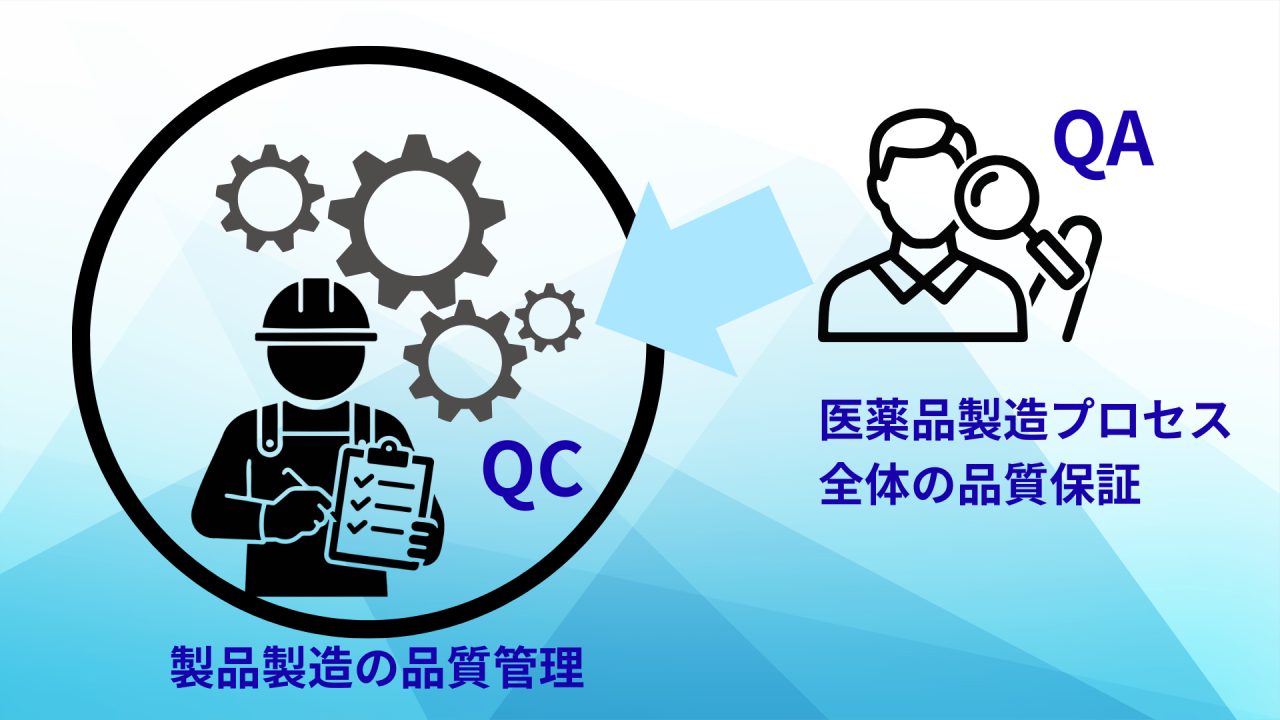
医薬品製造の現場で頻繁に使われる「品質保証(QA)」と「品質管理(QC)」という言葉。
「どちらも品質を守る仕事でしょ?」
「具体的にどこで線引きされるの?」
と、その違いに戸惑う方は少なくありません。
一言で言えば、QCは「作り手の視点」で製品をチェックし、QAは「買い手の視点」で安心を保証するという違いがあります。
この違いを理解せずに業務を進めると、品質トラブルへの対応遅れや、法規制(GMP)への不適合といった重大なリスクを招きかねません。
本記事では、QAとQCの決定的な違いを比較表で整理し、2021年のGMP省令改正で求められるようになった新しい「品質保証」のあり方まで解説します。また、現場の負担を減らす最新のAI活用術についてもご紹介します。
目次
1. 品質保証(QA)と品質管理(QC)の決定的な違い
QAとQCは、切っても切れない関係にありますが、その役割と視点は明確に異なります。
品質管理(QC):作り手視点での「検証」
品質管理(QC:Quality Control)の役割は、「製造された製品が基準を満たしているか検証すること」です。
工場などの製造現場において、不良品を出さないための「作り手視点」の活動と言えます。原材料のチェックから製造工程、最終製品のテストまでを行い、規格外の製品が次工程や市場に出るのを物理的に阻止する最後の砦です。
品質保証(QA):買い手視点での「保証」
品質保証(QA:Quality Assurance)の役割は、「お客様(患者様・医療機関)が安心して使える品質をシステム全体で保証すること」です。
製品そのものだけでなく、それが作られるプロセスやルールが正しいかを管理する「買い手視点」の活動です。市場に出た後のクレーム対応や安全管理情報の収集も含め、製品のライフサイクル全体に責任を持ちます。
【比較表】役割・視点・業務範囲の違い
両者の違いを図に整理しました。
| 項目 | 品質保証 (QA) | 品質管理 (QC) |
| 視点 | 買い手視点(顧客・患者) 安心・信頼の提供 | 作り手視点(製造現場) 規格適合・不良ゼロ |
| 主な役割 | 「仕組み」の保証 プロセス管理、出荷判定、品質システム構築 | 「製品」の検証 試験検査、データ分析、機器管理 |
| 時間軸 | 広範囲(開発〜市販後まで) 製品の一生を見守る | スポット(受入〜出荷前) 製造の瞬間を確認する |
| 主な業務 | 品質リスク分析逸脱/変更管理出荷判定市販後調査、リコール対応 | 原材料受入試験工程検査、製品試験分析機器の適格性評価 |
| GMPでの位置 | 全体統括、経営層への報告、PQSの維持 | 現場データの生成、試験室の管理 |
2. 医薬品GMPとPQS(医薬品品質システム)
製薬業界においてQA/QCを語る上で欠かせないのが、2021年(令和3年)施行のGMP省令改正です。
「製品チェック」から「システム管理」へ
かつての品質管理は「できた製品を検査して合格ならOK」という考え方が主流でした。しかし現在のGMPでは、医薬品品質システム(PQS)という概念が導入されています。
これは、「最終製品の検査だけでなく、経営陣の関与を含めた製造所全体の管理システムが健全に機能して初めて、品質が保証される」という考え方です。
そのため、現在のQA担当者には、単なる書類チェックだけでなく、以下のような高度な業務が求められています。
- 品質リスクマネジメント: 「どこにミスが起きるリスクがあるか」を科学的に分析・評価する。
- CAPA(是正処置・予防処置): 起きたミスを直すだけでなく、二度と起きない仕組みを作る。
- 継続的な改善: データを分析し、品質レベルを常に向上させ続ける。
3. 現場の連携フローと具体的タスク
QAとQCは、「QCが作った『証拠(データ)』を、QAが『審査』する」という基本動作で連携しています。 ここでは、医薬品製造の時系列に沿って、より実践的なタスクと文書のやり取りを見ていきましょう。
① 原材料受入・製造プロセス
製造が始まる前の段階から、両者の連携はスタートしています。
- QC(試験・検査)のタスク
- 受入試験: 原料・資材が入荷した際、倉庫でサンプリングを行い、規格に適合しているか試験します。
- 環境モニタリング: 製造エリア(クリーンルーム)の空気中の微粒子数や、製造用水の水質が基準内であることを毎日〜定期的に測定します。
- 工程検査(IPC): 製造の途中で中間製品を抜き取り、次の工程に進めて良いか素早く検査します。
- QA(保証・監視)のタスク
- サプライヤー管理: 原料メーカーの製造所を監査し、信頼できる相手か評価します(適格性評価)。
- 製造指図書のベース作成・発行: 「どの原料を、どの手順で混ぜるか」を定めた指示書(指図記録書)を製造現場へ発行します。
- ラインクリアランス: 前の製品のラベルや残留物が製造ラインに残っていないか、製造開始前に現場で確認します。
② 試験室での分析・データレビュー
製品が完成した後、出荷の可否を決めるための重要なフェーズです。近年はここでデータインテグリティ(DI)のチェックが厳しく求められています。
- QC(試験・検査)のタスク
- 出荷試験: 最終製品が規格(純度、含量、溶出性など)を満たしているか、HPLCなどの分析機器を用いて精密に測定します。
- OOS(規格外)対応: もし規格外のデータが出た場合、それが「検体のエラーか、分析ミスか、製品の不良か」を実験室レベルで一次調査します。
- 試験成績書(CoA)の作成: 全ての試験結果をまとめた公式文書を作成します。
- QA(保証・監視)のタスク
- 試験記録の監査: QCが出したデータに改ざんや不整合がないか、監査証跡(オーディットトレイル)を含めてダブルチェックします。
- バリデーション承認: QCが使う分析機器や試験方法が正しいことを証明する計画書・報告書を審査・承認します。
③ 出荷判定(バッチリリース)
QAにおける最大の責務です。単に試験に合格しているだけでなく、製造工程全体が正しかったかを審査します。
- QCの動き
- 「試験適合」のハンコを押した試験成績書をQA部門へ提出します。
- QAの動き(ここが重要)
- バッチレコード(製造記録書)の査読: 製造現場が記録した膨大な日報を隅々までチェックし、手順書(SOP)通りの作業が行われたか確認します。
- 逸脱(Deviations)の評価: 製造中や試験中に起きた「ルール違反」や「異常」について、品質への影響が解決されているかを確認します。
- 市場出荷判定: QCデータ、製造記録、逸脱処理の全てに問題がないことを確認し、品質保証責任者が「出荷可」の署名を行います。
④ トラブル対応と改善(CAPA)
問題が起きた時こそ、QAとQCの連携力が問われます。
- QC(事実の特定)
- クレーム品(不良品)の現物分析や、保管している参考品の再試験を行い、「何が起きているか」という客観的なデータをQAに提供します。
- QA(原因究明と再発防止)
- QCのデータや製造現場へのヒアリングを元に、根本原因を調査します。
- CAPA(是正処置・予防処置): 「手順書を書き換える」「教育訓練をやり直す」などの対策を指示し、その効果が出るまで追跡管理します。
4. 現場が抱える「文書作成」の課題と解決策
このように、QA/QC業務の連携や高度化(PQS導入など)に伴い、品質保証の質は向上しているものの、現場では「文書作成」の負担が激増しています。
手順書(SOP)、逸脱報告書、リスク評価書、変更管理申請書……。これらの作成に追われ、本来の「品質改善」に時間が割けないのが実情です。
製薬QA特化型AI「QAI Generator」
こうした課題を解決するために開発されたのが、株式会社EQUESの「製薬SaaS QAI Generator」です。
- 自動生成: 簡単な質問に答えるだけで、GMP/PQSに対応した文書案をAIが自動作成。
- 業務効率化: 文書作成時間を5割カット、レビュー時間を7割短縮した実績あり。(万協製薬様)
- 専門性: 東大松尾研発のAI技術と製薬専門知識を融合し、CAPAの下書きや法務書類にも対応。
「GMP省令改正で文書が増えた」「記録の整合性チェックが大変」
という現場の声を反映し、品質業務の本質的な部分に注力できる環境を作ります。また、UIや取り扱うデータをカスタマイズすることも可能で、確実に定着するAI品質保証を実現します。
まとめ
- QC(品質管理)は「作り手視点」で、試験・検査を通じて不良品を防ぐ(リアクティブ)。
- QA(品質保証)は「買い手視点」で、システム全体を管理し安心を保証する(プロアクティブ)。
- 最新トレンド: GMP改正により、QAには品質リスク分析や継続的な改善(PQS)といった経営に近い視点が求められている。
- 解決策: 複雑化する文書業務は、AIツール(QAI Generatorなど)を活用して効率化するのが正解。
品質の維持・向上は、企業の信頼そのものです。QAとQCの役割分担を明確にし、最新のツールを取り入れることで、より強固な品質保証体制を築いていきましょう。




