製薬業界における品質保証の現場で、「GMP文書」の作成や管理に多くの時間を費やされている方も少なくないのではないでしょうか。度重なる改訂作業、レビューの往復、そして査察への備えなど、その業務は膨大で、ヒューマンエラーのリスクも常につきまといます。求められる品質基準は年々高まる一方で、リソースは限られている、そんなジレンマを抱えているかもしれません。
この記事では、医薬品の品質を守るために不可欠なGMP文書の基礎知識から多くの品質保証(QA)部門が直面している具体的な課題、そしてそれらの課題をAIの力でどのように解決できるのかまでを分かりやすく整理します。
この記事を読み終える頃には、GMP文書管理の現状を打開するヒントが見つかり、業務効率化に向けた新たな一歩を踏み出すきっかけとなれば幸いです。
弊社(株式会社EQUES)は、製薬分野に強く、経済産業省のGENIACにも採択されたGMP文書業務効率化SaaS「QAI Generator」サービスを展開しております。事例集もございますのでぜひご活用ください。
目次
GMP文書とは?その重要性と基本を解説

GMP文書について理解を深めるために、まずはその土台となる「GMP」そのものについて確認しておきましょう。
GMPとは?医薬品の品質を守るルール
GMPとは「Good Manufacturing Practice」の略語で、日本語では「製造管理及び品質管理の基準」と表現されます。中でも医薬品に関わるGMPのことを医薬品GMPと呼びます。
医薬品は、人の健康や生命に直接影響を与えるものです。そのため、万が一にも品質に問題があってはなりません。医薬品GMPの目的は、製造過程での人為的な誤りを最小限にすること、医薬品の汚染や品質低下を防ぐこと、そして常に高い品質を保証するシステムを設計することにあります。
このGMPの基準は、厚生労働省令(「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」)が定めており、一般に「GMP省令」と呼ばれています。
GMP文書の役割と法的な位置づけ
GMP省令では、このGMPを確実に実行するために、いわゆる「GMPの三原則」が基本理念として示されています。
- 人為的ミスの防止
- 医薬品の汚染および品質低下の防止
- 高い品質を保つ仕組みづくり
これらの原則を実現するために不可欠なのが「文書化」です。GMP省令では、製造所の職員の責務や管理体制を文書によって適切に定めること や、作業手順を文書化してマニュアル通りに作業させ、それを記録することが求められています。
つまりGMP文書とは、GMP省令という法律に基づき、医薬品の品質を保証する仕組みを構築し、その仕組み通りに業務が実行されたことを証明するために作成・管理される、すべての文書と記録のことを指します。
医薬品GMP文書にはどんな種類がある?主な文書と管理プロセス
医薬品GMP文書と一口に言っても、その種類は多岐にわたります。これらは大きく4つのカテゴリーに分類することができます。
主な医薬品GMP文書の種類(基準書、手順書、記録書など)

GMP省令で要求される文書は、主に以下の4つに分けられます。
- 製品標準書
- 医薬品の品目ごとに、製造承認された内容や製造手順、品質規格、試験方法などをまとめた、その製品の「憲法」とも言える文書です。
- 基準書
- 製造所全体で守るべき基本的なルールを定めた文書です。
- (例)衛生管理基準書、製造管理基準書、品質管理基準書
- 手順書 (SOP: Standard Operating Procedures)
- 基準書に基づき、個々の作業や業務を「誰が、いつ、どのように行うか」を具体的に定めた文書です。
- (例)変更の管理に関する手順書、逸脱の管理に関する手順書、自己点検に関する手順書、教育訓練に関する手順書、文書及び記録の管理に関する手順書など、非常に多くの種類があります。
- 記録書
- 手順書に基づいて作業や試験を実施した結果を記録する文書です。作業が正しく行われたことを証明する「証拠」となります。
- (例)製造指図書に基づく製造記録、試験検査記録、変更申請書(変更記録)、自己点検記録、教育訓練記録
医薬品GMP文書の作成・承認・保管・改訂のライフサイクル
これらの医薬品GMP文書は、一度作成したら終わりではありません。常に最新かつ最適な状態を保つために、一連のライフサイクル(作成→承認→配布・教育→実行→保管→改訂→廃棄)に沿って適切に管理される必要があります。
特に保管については、例えば記録書は作成日から5年間(ただし有効期間+ 1年が5年より長い場合はその期間)の保管の義務(GMP省令第20条より)など、厳格なルールが定められています。
多くの企業が抱えるGMP文書管理の課題

GMP文書は医薬品の品質保証の根幹ですが、その管理には多くの課題が伴います。特に従来の紙ベースや手作業での運用では、以下のような問題が発生しがちです。
作成・レビューにかかる膨大な時間と人的コスト
GMP文書の作成、特にSOP(手順書)の新規作成や改訂には、多くの時間と労力が必要です。さらに、作成された文書は複数の部門や担当者によるレビューと承認を経る必要があり、このプロセスが長期化することも少なくありません。手書きやExcelでの文書作成は、時間がかかるだけでなく、貴重な専門人材のリソースを圧迫する大きな要因となっています。
整合性の担保とヒューマンエラーのリスク
GMP文書は、製品標準書を頂点として、基準書、手順書、記録書が互いに関連し合っています。紙ベースの管理では、一つの文書を改訂した際に、関連する他の文書への反映が漏れてしまう「不整合」のリスクがあります。
また、「用語の表記ゆれ」、旧版の文書を誤って参照してしまう、あるいは手書きによる記載ミスや読み間違い といったヒューマンエラーも起こりやすくなります。
査察対応とデータインテグリティの課題
当局による査察(ささつ)の際には、要求された文書や記録を迅速に提示する必要があります。しかし、紙の文書が書庫に膨大に保管されている場合、必要な文書をすぐに探し出すのは困難です。また、文書の紛失や劣化のリスク も伴います。
近年重視されている「データインテグリティ(データの完全性・正確性・信頼性)」の観点からも、手書きの記録は「いつ誰が変更したか」の追跡が難しく、データの信頼性を担保しにくいという課題があります。
薬機法の改正による規制の厳格化
2025年に施行された改正薬機法では、MAH(製造販売業者)による製造所の管理監督責任がより一層強化され、製造業者自身のGMP省令遵守も薬機法上で直接義務化されるなど、規制は厳格化しています。
PMDA(医薬品医療機器総合機構)においても、2025年4月から「医薬品品質管理部」に検定・検査課が新設されるなど、適合性調査(査察)の体制が強化されています。こうした背景から、査察や監査に対する文書管理の重要性は、ますます高まっていると言えるでしょう。
(参考元: 2024年度 GMP / GCTP Annual Report)
AIで変えるGMP文書業務の未来 – QAI Generatorのご紹介
こうしたGMP文書に関する根深い課題を解決する鍵として、今、AI(人工知能)の活用が注目されています。
AI活用がGMP文書業務にもたらす変革
AI、特に文章生成を得意とするAI技術は、GMP文書の作成・管理プロセスを劇的に変える可能性を秘めています。
例えば、膨大な時間がかかっていた文書の新規作成や改訂案の作成をAIがサポートすることで、担当者はより専門的な判断やレビュー業務に集中できます。また、AIによるチェック機能は、表記ゆれや参照漏れといったヒューマンエラーの防止にも貢献します。
EQUESの「QAI Generator」とは?
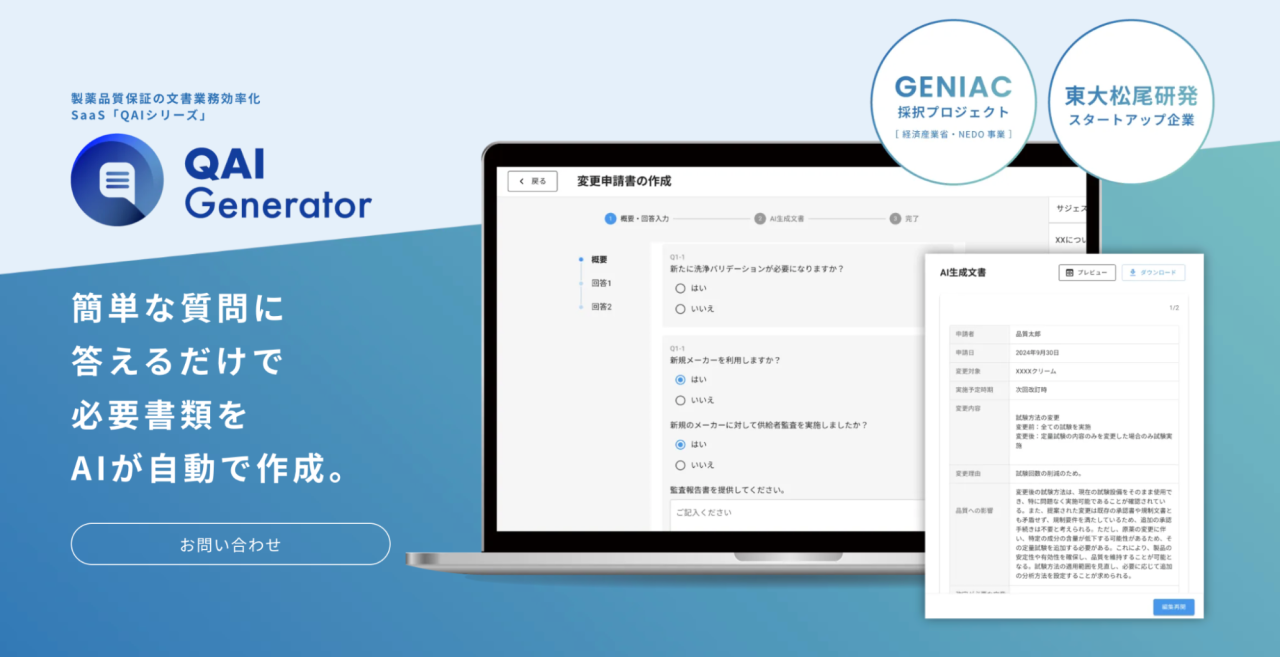
弊社、株式会社EQUESは、東京大学松尾研究所発のベンチャーとして、AIを用いた「伴走型技術開発」で企業様をサポートしております。特に強みを持つ製薬分野において、GMP文書業務の課題を解決するために開発したのが、製薬品質保証のGMP文書業務効率化SaaS「QAI Generator」です。
「QAI Generator」は、難解な操作を必要としません。簡単な質問に答えていくだけで、必要な書類や法務書類をAIが自動で作成します。
「QAI Generator」が実現する具体的な業務効率化
「QAI Generator」の導入により、GMP文書業務の効率は飛躍的に向上します。実際に導入いただいた企業様では、文章の作成時間が5割カットされ、さらにレビュー時間も7割以上短縮されたという実績が報告されています。
これは、AIがたたき台を作成することで「ゼロから書く」負担をなくし、同時に表記ゆれや形式の不備を減らすことで、レビューの手戻りを大幅に削減できるためです。
「QAI Generator」は、経済産業省のGENIACにも採択されており、その技術と将来性が高く評価されています。
GMP文書ツール導入で失敗しないためのポイント
AI活用を含め、GMP文書の管理ツールを導入する際には、いくつかの重要なポイントがあります。
自社の課題とツールの機能がマッチしているか
まずは、自社が抱える最大の課題がどこにあるのかを明確にすることが重要です。「文書の作成時間を短縮したいのか」「文書の検索性を高めて査察対応をスムーズにしたいのか」「文書の版管理や承認プロセスを電子化したいのか」によって、選ぶべきツールは異なります。
「QAI Generator」は、特に「文書作成とレビューの時間を大幅に削減したい」という需要に強いツールですが、ご要望に合わせて様式をカスタマイズすることを前提としており、幅広いニーズに対応することができます。
サポート体制と専門知識の有無
GMP文書は専門性が高く、業界特有の要件が多数存在します。そのため、ツールを提供するベンダーが製薬業界やGMPの業務プロセスを深く理解しているかどうかが、導入成功の鍵を握ります。万が一トラブルが起きた際や、運用方法に悩んだ際に、専門知識を持った担当者による手厚いサポートを受けられるかを確認しましょう。
弊社EQUESは製薬分野に特に強みを持っており、またAI専門家集団がお客様の困りごとに寄り添うサービス(AIDX寺子屋)も展開しておりますので、導入後も安心してご相談いただけます。
まとめ
今回は、医薬品の品質保証の要である「GMP文書」について、その基本から管理上の課題、そしてAIによる解決策までをご紹介しました。
| GMP文書とは、GMP省令に基づき、医薬品の品質を保証する仕組みと実行を証明する文書群です。 |
| 「製品標準書」「基準書」「手順書」「記録書」など多様な種類があります。 |
| GMP文書の管理は、法律で定められた義務であると同時に、多くの企業にとって大きな負担となっている現実があります。 |
| 従来の紙や手作業による管理では、作成・レビューの時間、ヒューマンエラー、査察対応の非効率性といった課題がありました。 |
| AIを活用した「QAI Generator」のようなツールは、これらの課題解決に有効です。簡単な質問に答えるだけでAIが文書を自動作成します。実際の導入例では、作成時間が5割、レビュー時間が7割以上も短縮されています。 |
もし、貴社がGMP文書の作成・管理に課題を感じていらっしゃるなら、AIの力を活用してみませんか。
弊社(株式会社EQUES)は、製薬分野に強いAI専門家集団 として、貴社の業務効率化を全力でサポートします。ご興味をお持ちいただけましたら、ぜひお気軽にお問い合わせください。




